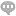2005年医疗器械网络销售立法和监管逐步放开,但是医疗器械的合规性不只体现在研发和销售环节,还体现在企业的日常运营中,医疗器械企业的采购和销售行为也需要符合一系列的法规标准。企业在采购和销售过程中,需要确保产品的合规性,避免因违规行为而受到处罚。总的来说,医疗器械的合规性是企业在整个产业链中必须严格遵守的一系列法规和标准。只有遵循这些法规和标准,企业才能确保产品的合规性,保护消费者的权益,同时也能保证企业的生存和发展。 医疗器械设计开发中的挑战在于合规性,需满足严格法规和标准。江苏医疗器械设计开发诚信合作
评审的主要目的是为了评价设计和开发的结果是否满足预期的要求,同时识别可能出现的问题并提出必要的行动措施。这是确保产品或服务达到预定目标和满足用户需求的关键步骤。评审的过程可以帮助团队发现潜在的问题和风险,从而及时采取措施进行纠正,避免在后期阶段出现更大的问题。评审的另一个重要性在于,它可以帮助团队识别和弥补自身能力的不足。通过邀请组织外的其他人员参与评审,可以提供不同的观点和经验,有助于发现设计和开发过程中可能被忽视的问题。此外,评审还可以确保设计和开发过程的合规性,例如满足相关的法律、法规和标准要求上海医疗器械委托代加工生产原材料的选择与供应链保障关系着产品的质量和稳定性。
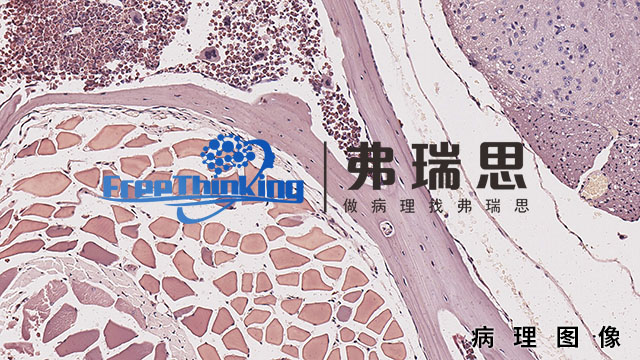
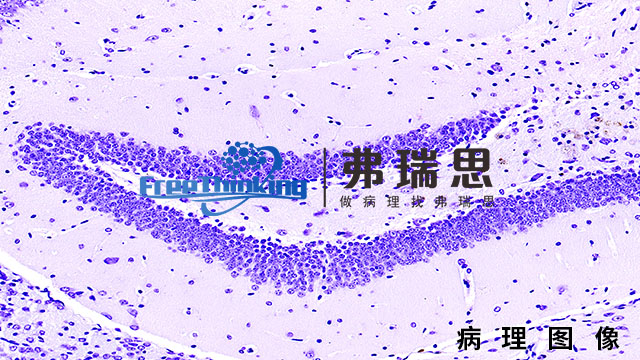
医疗器械研发阶段的生物相容性是确保器械安全有效应用于人体的关键环节。它指的是医疗器械与人体组织、细胞及生物系统之间的相互作用,要求器械在接触人体时不会引起毒性、过敏、炎症等不良反应。为确保生物相容性,研发阶段需进行严格的材料筛选、生物相容性测试和评估。这包括选择符合生物安全标准的材料,通过体外和体内试验验证材料的生物相容性,以及评估器械在人体内的长期安全性和有效性。同时,研发团队还需密切关注人体对器械的免疫反应和生物降解等因素,确保器械在人体内具有良好的耐受性和功能性。因此,医疗器械研发阶段的生物相容性是保障患者安全和器械性能的重要考量,也是推动医疗器械创新发展的基础。
医疗器械研发阶段的开发策划是确保项目成功、满足法规要求及市场需求的关键。它涉及明确项目目标、分析市场与用户需求、遵循法规标准、评估技术可行性、规划质量管理、识别并管理风险、分配资源、制定时间表与预算、确立沟通机制、管理变更以及规划项目结束与交接。有效的开发策划能提升项目成功率、降低风险,并确保产品的安全有效及市场竞争力。策划过程是动态的,需随项目进展调整优化,以适应不断变化的环境和需求。通过精心策划,医疗器械研发项目能够更高效、有序地推进,为产品的成功奠定坚实基础。医疗器械研发中的每一个细节都可能影响产品的终端性能和效果。
在设置评审点时,需要考虑产品的风险大小和复杂性,以及设计和开发过程的不同阶段。评审点的设置并不是越多越好,过多的评审点可能会增加管理难度,延长开发周期。相反,如果评审点太少,可能会给设计和开发带来较大的风险,难以保证开发质量。评审人员的选择也是非常重要的。他们应该是具有资格的人员,包括设计和开发阶段的职能负责人、项目团队成员,以及组织外的其他人员,以补充项目团队能力的不足。在评审过程中发现的问题需要及时归零,以确保评审效果。思脉得提供全产业链服务,确保设计到生产的顺畅过渡。广东医疗器械设计开发有哪些
思脉得选择质优供应商,保障医疗器械制造的可靠性。江苏医疗器械设计开发诚信合作
医疗器械的可用性是指预期用户在预期使用场景下正常使用医疗器械时,保证医疗器械安全有效使用的用户接口易用特性。易用特性包括但不限于易读性、易理解性、易学习性、易记忆性、易操作性、用户差错防御性等特性。可用性工程亦称人因工程、人机工效学/人体工程学。可用性总的来说,是产品对于用户来说是否有效,简单,易学、高效、少犯错。产品是否符合用户需求、期望等。但现在实际很多公司比较重视技术的创新,忽视了人类的因素,导致很多产品在可用性方面存在问题。特别对于医疗器械企业来说,如何让设计人员理解可用性,将可用性的问题从源头上解决,产品设计完成之后,如何对可用性进行验证和确认。从医疗器械注册人员的角度来看,可用性验证和确认是目前做CE认证和FDA认证必须要提交的资料之一,相信在不久的将来也会成为中国注册资料中的一部分,根据笔者的经验,目前大多数公司在可用性方面还是流于形式,并未对可用性有比较深入的理解和实践。江苏医疗器械设计开发诚信合作
文章来源地址: http://swfw.ehsy.com-m.chanpin818.com/yiliaofuwu/deta_20502109.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。




 [VIP第1年] 指数:3
[VIP第1年] 指数:3